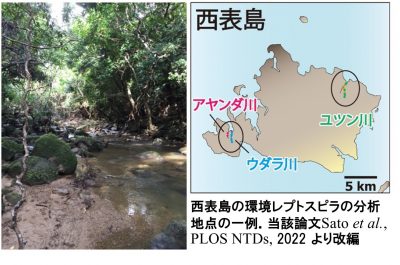
|
琉球大学の佐藤行人講師、トーマ・クラウディア准教授らの研究チームによる成果が、米国の学術雑誌「PLOS Neglected Tropical Diseases」誌に掲載されます。 <発表のポイント>
|
<発表概要>
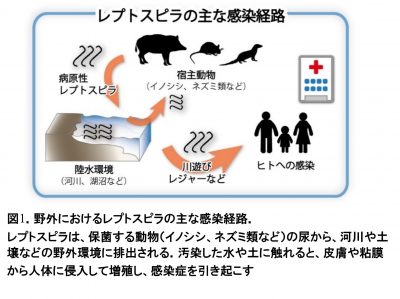
レプトスピラ症は熱帯・亜熱帯地域に多く見られる人獣共通感染症の一種です。沖縄県の患者発生は他県に比べて多く(全国の届出の半数が沖縄)、河川でのレジャーによる集団感染の報告も多数あります。また、沖縄県内の北部(やんばる)と八重山地方(石垣島、西表島など)が、届け出件数の多い地域となっています。レプトスピラ症の原因細菌であるレプトスピラは、皮膚・粘膜からヒトや哺乳類などの動物の血流に入り、肺や腎臓などの標的臓器へと拡がります。腎臓に定着したレプトスピラは尿と共に川や土壌を汚染し、感染源の一つとなります(図1;注1)。しかしこれまでは、八重山諸島でのレプトスピラの生態疫学は不明なままでした。
本研究では、新たに世界遺産登録された八重山諸島の西表島を対象に、病原性レプトスピラの分布と多様性について、分離培養と環境DNA分析(注2)に基づいた体系的な調査を行いました(図2)。さらに、八重山諸島の臨床培養株と、今回西表島から分離培養された環境株を比較することで、病原遺伝子の有無や細胞の接着装置の破壊能(注3)について調べました(図3)。その結果、島の東側に位置するユツン川と、島の西側奥地にあるウダラ川・アヤンダ川ともに、7~8種の多様な病原性レプトスピラの種が検出されること、また、その宿主動物の候補としてクマネズミ類やイノシシのDNAが同時検出されることが示されました(図4)。さらに感染実験の結果、八重山諸島の臨床培養株が、ヒト細胞接着装置の破壊による強力な感染力を持つことが示されました(図3)。これらの結果は、八重山諸島や西表島における環境衛生管理を考える上で、非常に有用な情報となります。
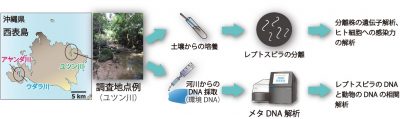 図2.本研究で行った沖縄県・西表島におけるレプトスピラの調査. |
レプトスピラについて:レプトスピラは、イノシシやネズミ類、家畜を含む多くの哺乳類に感染し、高熱や黄疸、腎障害などを起こす人獣共通感染症(注4)の病原細菌です。レプトスピラを保菌する動物の尿から、水や土壌が汚染され、それにヒトの皮膚や粘膜が触れることで感染が起きます。レプトスピラ症は深刻な集団発生を起こすことがあり、東南アジアのタイやインドネシア、環太平洋地域のパラオ共和国やニューカレドニア、中南米のブラジルやパラグアイ、アフリカのエチオピアなど、世界の熱帯・亜熱帯地域で発生します。全世界で年間およそ100万件以上の症例があり、6万人近くが亡くなっていると推定されています。
上記の病原体レプトスピラは、単離・培養することが比較的困難な細菌です。そのため、レプトスピラがヒトの細胞に侵入する仕組みや、レプトスピラが自然環境中でどのように分布するか、感染源の野生動物が何であるのかを分析するために、現在も多くの基礎研究や技術開発がなされています(注3、注5、注6)。レプトスピラ症が発生する地域で、レプトスピラが実際にヒトへの病原性を示す機構を調べたり、レプトスピラの自然分布や宿主動物を調べたりすることは、流行地における適切な予防方針を得る上で極めて重要です。世界遺産登録された西表島を含む八重山諸島も、亜熱帯に属するレプトスピラ流行地であるため、地域住民やレジャー利用者の保護のために、レプトスピラの生態疫学研究が重要な課題です。
そこで本研究は、八重山諸島のレプトスピラについて、(1)八重山諸島・西表島の土壌からの分離・培養、(2)ヒト細胞への感染実験、(3)同・河川水からの環境DNA分析、という3つの手法を駆使し、その体系的な生態疫学研究を試みました。
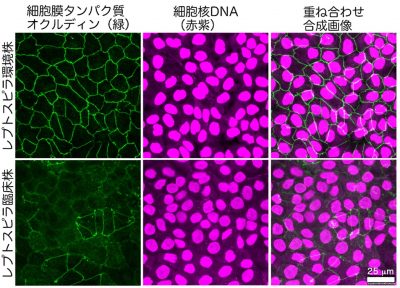 図3.八重山諸島のレプトスピラ臨床株および環境株のヒト細胞への感染実験. レプトスピラで感染させたヒト腎上皮細胞のオクルディン(接着装置の膜タンパク質)を緑、細胞の核を赤紫に染色し、共焦点レーザー顕微鏡により可視化した. 最右段は、左側2段の画像から、細胞全体を観察するために重ね合わせた画像.レプトスピラ環境株で感染した細胞ではオクルディンは細胞膜に局在したが、 レプトスピラ臨床株で感染させた上皮細胞ではオクルディンが著しく減少し、細胞間接着装置が破壊されたことを示している.当該論文Sato et al., PLOS NTDs, 2022 より改編 |
世界で初めての観察:まず、西表島のレプトスピラ発症地であるユツン川の土壌からレプトスピラの環境分離株を培養することに成功しました。また、シャーレ上で培養したヒト腎表皮細胞への感染実験を行うことで、ヒト細胞への病原性、すなわち直接的な侵襲性を確認しました。その際、2007年から2017年の間に沖縄県衛生環境研究所によって分離された臨床培養株についても同じ実験を行って、侵襲性を比較しました(図3)。その結果、臨床培養株では極めて強力な細胞間接着装置の破壊が引き起こされており、緑色で染色されたヒトの細胞膜構造が全般的に損なわれている様子が観察されました(図3:下段)。また、西表島の土壌から得られた環境分離株でも、臨床株ほど強力ではないものの、ヒト細胞膜の損壊や弱体化を起こすことが同様に観察されました(図3:上段)。野外環境から得られたレプトスピラがヒト細胞を破壊する様子を捉えたのは、本研究が世界初となります。
環境DNA分析:さらに本研究では、単離・培養が難しいレプトスピラの野外における分布や多様性の全体像を調べるために、河川水から直接DNAを解析する「環境DNA分析」(注2)を活用しました。この手法は、川や海などの環境水中に懸濁物として含まれる微量なDNAを直接抽出し、その塩基配列を大量に決定することによって、微生物や動物の存在を高感度で分析するものです(図2)。トーマ准教授と佐藤講師らは、この環境DNAに基づいたレプトスピラの高感度分析法を開発し、すでに沖縄県やスリランカの流行地で成果を挙げています(注5、注6)。
西表島の東側の県道沿いで観光利用が比較的多いユツン川と、島の西側奥地に位置し、主に船でしかアクセスされないウダラ川およびアヤンダ川で環境DNAサンプルを採取し(図2)、レプトスピラ属細菌と脊椎動物をターゲットとした解析を行いました。レプトスピラの検出のために16S rRNA遺伝子(注7)、脊椎動物の検出のためにミトコンドリア12S rRNA遺伝子(注8)をPCR法で増幅し(注9)、増幅したDNAを次世代シークエンサー(注10)により大量網羅的に配列決定しました。それらの配列が由来する生物種とその検出配列数を、国立遺伝学研究所スーパーコンピュータを用いて解析しました(図4)。
その結果、病原性レプトスピラとして合計10種に相当する配列が検出され(図4)、強い病原性を示す種が東側のユツン川から3種、中程度の病原性を示す種がユツン川、西側のウダラ川、アヤンダ川から合計7種検出されました。さらに、レプトスピラと同時に検出される哺乳類としてヒト、クマネズミ類、イノシシが見出され、それらのうちクマネズミ類では統計的に有意な相関関係が示されました(ピアソンの積率相関係数 p < 0.05、Benjamini & Hochberg 法による多重検定補正 q < 0.01)(図4)。
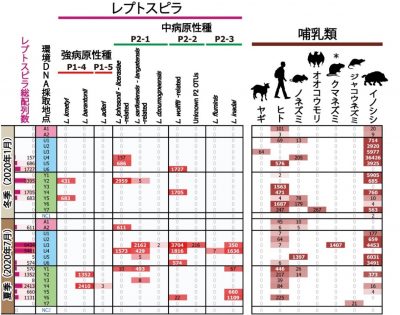 図4.西表島におけるレプトスピラおよび哺乳類の環境DNA分析の結果. |
環境DNA分析が示す大切なこと:以上の結果は、2つの重要な示唆を与えます。1つ目は、西表島内での交通アクセスの良し悪しを問わず、病原性レプトスピラが同程度の多様性を示して分布することです(図4)。このことは、病原性レプトスピラの自然分布が、人間活動の影響の強弱よりも、宿主動物の分布に左右されることを示唆すると考えられます。レプトスピラの検出配列数と種多様性指標値(Shannon指数H ')は、ともに、東西の2地域の間で有意差はありませんでした。夏季に検出配列数が多い傾向は見られ、これは一般に、夏にレプトスピラ症が発生することと合致します。
2つ目の重要な示唆は、レプトスピラの宿主動物(感染源)が何であるかについてです。今回は、宿主としてすでに知られている野生イノシシに加えて、クマネズミ類が、レプトスピラと同時に検出されてきました(図4)。クマネズミ類については、もともと西表島に生息している種に加えて、外来種が侵入してきていることが懸念されています。つまり、外来種のクマネズミ類が、レプトスピラを拡散・媒介している可能性が指摘されます。このことは、外来種の侵入が、世界遺産である西表島の生物多様性保全だけではなく、人間の健康福祉の問題にも直接的に関与することを示唆するものです。新型コロナウィルスもそうであるように、多くの潜在的病原体では、自然界では宿主動物が不明な場合が多くあります。今回のレプトスピラの例のように、病原体の宿主動物を環境DNAから探索・推定するという手法は、レプトスピラの他にも様々な病原体の研究と疾病の予防において、有用である可能性が示唆されます。
今後の展開:今回の研究では、強い病原性を示す種であるLeptospira interrogans が環境から検出されなかった点など、幾つか未解決の課題も残りました。今後はさらなる取り組みと研究を継続することによって、自然環境下におけるレプトスピラの分布や生態についての理解が深まることが期待されます。また、そのことが、西表島を始めとする八重山諸島や沖縄県における、自然環境の保全や適切な管理の持続的維持につながると考えられます。また、この研究で用いた手法は、世界の亜熱帯・熱帯地域における他の病原体の研究においても、重要な示唆を提供するものと期待できます。
<用語解説>
(注1)レプトスピラ: らせん形の細長い細菌。64種ほどが知られており、病原性・低病原性・非病原性に分けられる。病原性と低病原性の種は、人獣共通感染症のレプトスピラ症を起こす。
(注2)環境DNA: 河川水や土壌などの環境媒質中に微量に含まれる生物由来のDNA断片。主な由来は、付近に生息する生物の皮膚片や羽毛、粘液、細胞片、死骸などであると考えられている。
(注3)琉球大学・東北大学・沖縄科学技術大学院大学(OIST)2021年4月23日共同ニュースリリース: 「病原細菌が臓器を壊して感染する仕組みを解明~レプトスピラ症の新しい予防・治療法開発に期待~」https://www.u-ryukyu.ac.jp/news/22330/
(注4)人獣共通感染症: ヒトと動物(哺乳類・鳥類など)に、共通して感染する病原体によって発症する疾患(病気)のこと。病原体となるものは、インフルエンザウィルスなどのほか細菌、真菌、原虫、寄生虫など多岐に渡る。
(注5)琉球大学・新潟大学・神戸大学2019年4月25日共同ニュースリリース: 「川の水から人獣共通感染症の病原体と保菌動物の候補を同時検出 ~レプトスピラ症予防に向けた環境DNA分析手法を開発~」https://www.u-ryukyu.ac.jp/news/4788/
(注6)琉球大学・スリランカ・ペラデニヤ大学2020年7月27日共同ニュースリリース: 「顧みられない熱帯病「レプトスピラ症」の感染源を環境DNAから推定~世界の熱帯・亜熱帯で役立つ手法を沖縄から発信、スリランカで実証~」https://www.u-ryukyu.ac.jp/news/14997/
(注7)16S rRNA: タンパク質の生成に関わるリボソームRNAの一部をコードする遺伝子。バクテリアなどの原核生物に広く共通する遺伝子であるため、種判別に多用される。
(注8)12S rRNA: タンパク質の生成に関わるリボソームRNAの一部をコードする遺伝子。脊椎動物など多細胞動物では、ミトコンドリアゲノム上に広く共通して存在する遺伝子であるため、種判別に利用される。
(注9)PCR: ポリメラーゼ連鎖反応の略。DNAの集合から、ターゲットとする特定の配列に挟まれた領域を生化学的に増幅する方法。ごく微量の環境DNAサンプルから、多数のコピーDNAを得て、DNA配列決定などの分析に使用することができる。
(注10)次世代シークエンサー: 数千万から数億分子のDNAについて、同時並列的に塩基配列を解読することができる機器。2004年ごろから普及し、生物学で使われる重要技術の1つになっている。
<謝辞>
本研究は、文部科学省・科学研究費補助金(20K12258、21H02732)および研究拠点形成事業(JPJSCCB20200007)、琉球大学・時空間ゲノミクスプロジェクト、島嶼防災研究センター研究・活動助成、熱帯生物圏研究センター研究助成、ならびに、沖縄県医科学研究財団・研究助成のもとで行われました。また、琉球大学・研究基盤センターおよび戦略的研究プロジェクトセンターによる共同利用・共同研究の支援を受けました。さらに、情報・システム研究機構・国立遺伝学研究所が有する遺伝研スーパーコンピュータシステムを利用しました。
本プレスリリース記事の作成にあたり、琉球大学・広報戦略本部、研究推進機構・研究企画室、同大リサーチ・アドミニストレーターの助言と支援を受けました。
<本記事内の図およびイラストレーション>
本記事で使用した図およびイラストレーションは、当該論文の著者らによって作成されました。研究の概要や結果を説明する図は、論文の内容および図に基づき、本記事に向けたレイアウトの変更や日本語注釈の追加などを加えて、作成しました。動物、器具・機器その他のイラストレーションは、写真資料や、国土交通省国土地理院が配布する地図(https://maps.gsi.go.jp/)に基づき、主著者・佐藤が作成しました。
<論文情報>
タイトル: Analysis of human clinical and environmental Leptospira to elucidate the eco-epidemiology of leptospirosis in Yaeyama, subtropical Japan
(和訳)八重山諸島におけるレプトスピラ症の生態疫学的解明を目指した臨床および環境由来株の解析
雑誌名: PLOS Neglected Tropical Diseases
著 者: Yukuto Sato, Idam Hermawan, Tetsuya Kakita, Sho Okano, Hideyuki Imai, Hiroto Nagai, Ryosuke Kimura, Tetsu Yamashiro, Tadashi Kajita, Claudia Toma
佐藤行人(琉球大 医学部附属 実験実習機器センター 講師)、イダム・ヘルマワン(琉球大院 医学研究科 技術補佐員)、柿田徹也(沖縄県衛生環境研究所 研究員)、岡野祥(沖縄県衛生環境研究所 主任研究員)、今井秀行(琉球大 理学部生物系 准教授)、永井大翔(琉球大 理学部生物系 大学院生)、木村亮介(琉球大院 医学研究科 准教授)、山城哲(琉球大院 医学研究科 教授)、梶田忠(琉球大 熱帯生物圏研究センター 西表研究施設 教授)、トーマ・クラウディア(琉球大院 医学研究科 准教授)
DOI番号: 10.1371/journal.pntd.0010234
URL: https://journals.plos.org/plosntds/article?id=10.1371/journal.pntd.0010234