|
琉球大学の佐藤行人・准教授、仙台大学の櫻井雅浩・教授、宮城県立がんセンターの安田純・研究部長の研究チームによる成果が、英国の学術雑誌「Journal of Freshwater Ecology」誌に掲載されました。 |
<発表のポイント>
- 食用牡蠣(カキ)による食中毒は毎年発生するが、カキの蓄積するノロウイルスが何に由来するのかは不明瞭な部分があった。
- 三陸沿岸のカキ出荷のシーズンに合わせて、環境DNA解析による網羅的な動物相の分析を行い、食用カキからノロウイルスが検出された時期と、動物種の出現パターンの相互相関を解析した。
- 食用カキでのノロウイルスの検出は、カモ類、ハクチョウ類の飛来と同調して起きていることを発見した。鳥類がノロウイルスの運び屋(ベクター)である可能性『ノロウイルス動物由来モデル』を提起した。
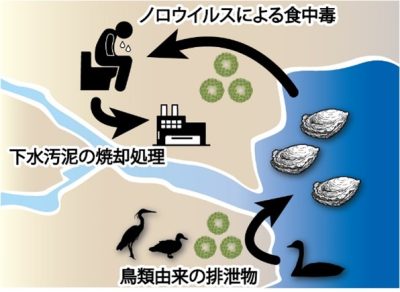
本研究が提唱する、食用カキのノロウイルスは動物に由来するというモデル.当該論文Sato et al., J. Freshw. Ecol. 2023 より改編
<発表内容>
しばしば生食される食用の牡蠣(カキ)は、日本人のみならず外国人観光客からの人気も高く、我が国において、重要な食料資源かつ観光資源の1つであると言えます。しかし、カキの生食による食中毒は毎年のように発生しています。カキによる食中毒は、多くの場合、食中毒の原因となったカキ個体の体内に蓄積していたノロウイルス(注1)に起因します。
カキは、生態学的には海水中の懸濁物を濾し取って摂食する「ろ過食者」であり、カキに蓄積されるノロウイルスは、海水から取り込まれることが分かっています。では、海水に含まれるノロウイルスは、どこから来ているのでしょうか。このノロウイルスの由来については、実は、未だはっきりとは解明されていないのが現状です。
ノロウイルスの食中毒患者から排出されたウイルス粒子が、トイレと下水を通じて沿岸海域に流れ込み、カキに蓄積するという考え方があります(図1A)。しかし日本を含む先進国では、2000年代前後から下水汚泥の焼却処理が広く普及しました。そのため、下水に排出されるノロウイルスが、活性を持った状態で海水へ放出されるということは、少なくとも先進国の多くの地域では、通常は起にくいと想定されます。つまり、食用カキへのノロウイルスの蓄積は、従来考えられてきた下水由来モデルだけでは説明できない可能性があります。
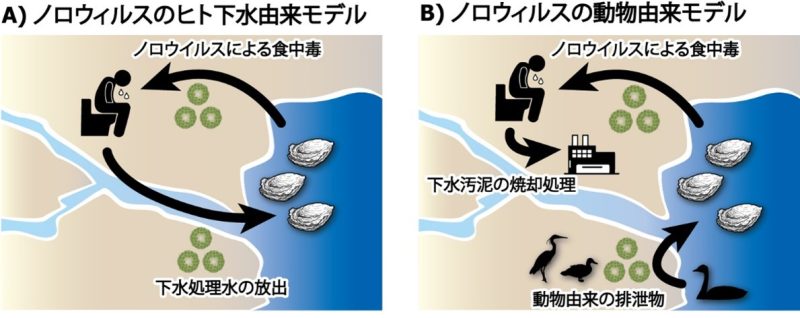
図1.ヒトノロウイルスの由来に関する2つのモデル.
(A)ノロウイルスの下水由来モデル。牡蠣(カキ)に蓄積するノロウイルスの由来を説明する考え方として従来から採用されてきた。食中毒患者から排出されたノロウイルスが、下水を通じて海水に還流し、再びカキに蓄積・濃縮されるというモデル。(B)ノロウイルスの動物由来モデル。カキが蓄積するノロウイルスは、沿岸海域を生活の場とする動物によって排出されて海水中にもたらされ、カキに蓄積・濃縮されるという、本研究が提起するモデル。
そこで本研究は、カキの蓄積するノロウイルスが、沿岸海域を生活の場とする動物によってもたらされるという『ノロウイルス動物由来モデル』を提案します(図1B)。この、動物がノロウイルスの運び屋(ベクター)であるという考え方の是非を検討するために、カキの代表的産地である宮城県・松島湾において食用カキのシーズンに海水を採取し、環境DNA分析を行いました。海水を環境DNA分析(注2)の技術で解析することによって、海水に含まれる動物由来のDNAを網羅的に調べ(図2)、ノロウイルスの検出と同調して出現する動物種について統計的に分析しました。
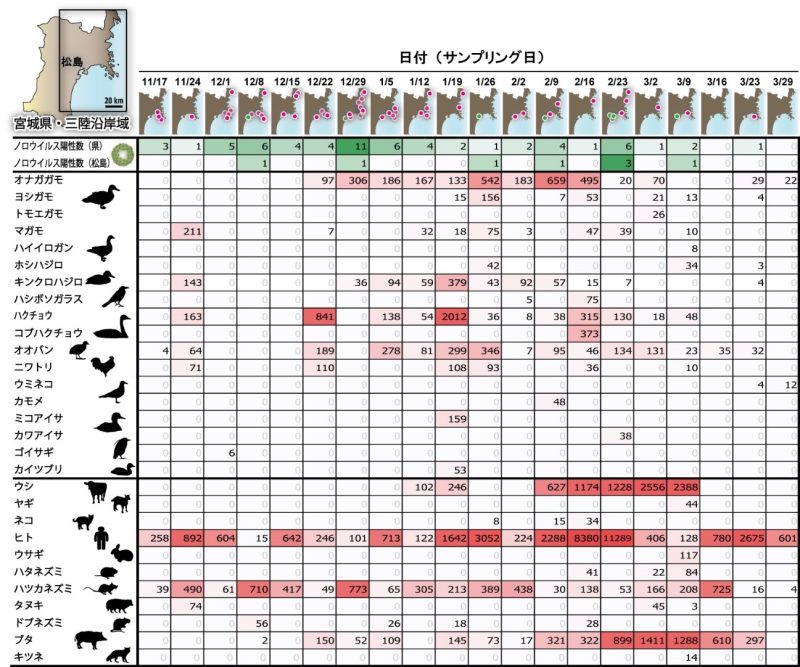
図2.食用カキのシーズンにおけるカキからのノロウイルスの検出パターンと、同日に海水からDNA検出された動物相(鳥類および哺乳類)(宮城県松島湾).
図の列(縦行)は食用カキのノロウイルス自主検査が実施された日付に対応しており、図の行はノロウイルス検査の陽性数(緑)、および検出された動物種(赤)を示す。最上列は県全体でのノロウイルス陽性の検査数であり、上部の地図に陽性が検出された場所がプロットされている。上から2番目の列は松島湾内におけるノロウイルス陽性の検査数を示している。各動物種の行に示されている数値は、環境DNA解析で検出された各動物種に由来するDNA配列の数を示す。
分析の結果、食用カキからノロウイルスが検出されるタイミングと同調して出現する動物類として、カモ類、ハクチョウ類、カラスなど6種の鳥類(オナガガモ、ヨシガモ、ホシハジロ、キンクロハジロ、ハシボソガラス、ハクチョウ)と、1種の哺乳類(イエネコ)が同定されました(有意水準 p < 0.01、Benjamini–Hochberg法による多重比較検定の補正(注3)後の偽発見率 q < 0.01)。この解析では、食用カキからのノロウイルスの検出日・場所として、県内漁協の自主検査(RT-PCRに基づく自主検査;注4)の結果を用いています(図2上部に表示された「ノロウイルス陽性数」)。それらの検査とほぼ同じタイミングで松島湾沿岸の海水を採取し、環境DNA解析を行いました。検出された計18種の鳥類、11種の哺乳類の出現パターンを解析したところ(図2赤のヒートマップとして表示)、ノロウイルスの検出タイミングとの間に有意な相互相関(注5)を示す動物として、上記の7種が見つかりました。。この分析によると、カモ類、ハクチョウ類の飛来からおよそ4~5週間後、および、カラス、イエネコの出現からおよそ1週間後に、カキからノロウイルスが検出される傾向があることが示唆されました。
上記のノロウイルス検出と動物の間の相互相関関係について、幾つかの異なる視点を導入してさらに検討しました。まず、カキからのノロウイルスの検出は、天候や雨などの環境因子によっても影響を受ける可能性があります。実際に、気象庁データベースから取得した雨量(mm)とカキからのノロウイルス検出との間には、有意な相互相関が見出されました(有意水準 p < 0.01)。そこで、雨量の影響を補正した相互相関(偏相互相関;注6)を調べましたが、上記の7種の動物がノロウイルスの検出と同調しているという結果には変化はありませんでした(有意水準 p < 0.01、多重比較検定の補正後の偽発見率 q < 0.01)。さらに、得られる結果を別の統計的尺度でも確認するために、各動物の環境DNA解析の結果である配列数を、絶対数(半定量的指標)ではなく比率(100万分率による相対的指標)に変換して相互相関を調べました。この場合には、ノロウイルスの検出と有意に同調しているとされる動物種が、5種(ヨシガモ、ホシハジロ、ハシボソガラス、ハクチョウ、イエネコ)に減少したものの、結論としてはほぼ同じ見解が得られることが分かりました。
上記の結果をまとめると、カモ類、ハクチョウ類という渡り鳥が三陸沿岸に飛来してから約1ヶ月後に、三陸沿岸で水揚げされる食用カキの一部からノロウイルスが検出されるという現象が指摘されます。季節性の渡り鳥がノロウイルスの自然宿主であり、それらが排出した糞尿を介してノロウイルスが沿岸海水に混入し、食用カキの一部に蓄積されるという『ノロウイルス動物由来モデル』(図1B)が支持されます。このモデルをより直接的に証明するためには、今回ノロウイルスとの関与が疑われた鳥類の腸管や糞便から、直接ノロウイルスを検出することが次の課題となります。今回の研究で、環境DNA分析による動物相の解析という網羅的な手法を活用したことから、ノロウイルスの自然宿主の有力な候補として鳥類の種を推定し絞り込むことが出来たと考えられます。
カラスとイエネコについては、カキからノロウイルスが検出される約1週間前にその環境DNAが海域に出現することが示されたものの、その生態疫学的な解釈は不明です。フィンランドで行われた別の研究では、今回と同じハシボソガラスの糞便に、ノロウイルスが含まれることが示されています。このことから、カラスとイエネコも、ノロウイルスの自然宿主の候補として、今後の重要な調査対象になり得ることが示唆されます。
本研究で提起する『ノロウイルスの動物由来モデル』は、従来から考えられてきたノロウイルスの下水由来モデルと、互いに相反するものではありません。下水由来モデルでは、ノロウイルスが人間の生活排水から下水、沿岸域へと移動し、カキへと蓄積する感染環を想定しています。今回の動物由来モデルは、下水由来モデルが想定する感染環よりもさらに上流に相当する、人間が感染する前のノロウイルスの由来について説明を与え得るものです。このことからノロウイルスの動物由来モデルは、従来の下水由来モデルを補完して、ノロウイルスの感染環についての理解を深める可能性があると考えられます。また、本研究を発展させることによって、ノロウイルスの自然宿主である動物種を特定することが出来れば、その動物の細胞を使用したノロウイルスの増殖が可能になると期待されます。ノロウイルスの増殖は、ワクチンや小分子薬剤の開発等といった治療応用への道を切り拓く可能性があります。
<用語解説>
(注1)ノロウイルス: 小児だけでなく成人も発症する感染性胃腸炎および感染性下痢の原因としてもっとも一般的なウイルス。エンベロープ(脂質膜)を持たないノンエンベロープウイルスであり、また、ゲノムの核酸としてRNAを持つRNAウイルスである。実験室的に増殖させることが困難であることから、検査や治療方法に関する研究が比較的遅れている。
(注2)環境DNA: 海水、河川水、土壌などの環境媒質が含有しており、周辺に生息する生物に由来すると考えられるDNAの総称。これを分析することで、周囲の生物種の分布や、環境中に分布する遺伝子の配列などを調べることが出来る。主な由来は、生物の皮膚片や羽毛、粘液などの細胞片、排泄物などであると考えられている。
(注3)多重比較検定の補正: 統計的検定によって有意確率(p値)や有意差を調べる際に、数十回から数百回以上の多数の検定を並列して行うと、実際には有意でないにも関わらず偶然によって有意と判定される検定結果が一定数混入してくる。このような偽陽性・偽発見を抑制するために、多重比較検定の結果を補正する手法が開発されている。本研究で採用したBenjamini–Hochberg法では、有意確率の自然分布をシミュレートして閾値を設けることで、偽発見率が低く確からしい、上位の検定結果を選別する。
(注4)RT-PCR: 逆転写ポリメラーゼ連鎖反応(Reverse Transcription Polymerase Chain Reaction)の略。RNAを鋳型とした逆転写反応を行なってDNAを合成した後、そのDNAを鋳型にしてPCR増幅を行う生化学的な手法。ノロウイルスや新型コロナウイルスなどのRNAウイルスを検出する手法としても利用される。
(注5)相互相関(相互相関関数): 2つの信号データが互いに類似しているかどうかを統計的に検討し評価する指標。一定の間隔で取得された2系列の信号データについて、データ間にタイムラグを仮定して類似性を調べ、その類似性を定量的に表すことが出来る。
(注6)偏相互相関: ある2つの変数の間の相互相関について、別の第3の因子(交絡因子)による影響を数学的に取り除いた状態の評価値。一般的な相関解析における偏相関に相当する。
<謝辞>
本研究は、科学研究費補助金(15K18590、17K19298、20K12258、23H03589)による支援のもとで行われました。また、琉球大学・時空間ゲノミクスプロジェクトならびに、同大学・研究基盤統括センター、研究企画室、戦略的研究プロジェクトセンターによる共同利用・共同研究の支援を受けました。本プレスリリース記事の作成にあたり、琉球大学・研究推進機構・研究企画室、同リサーチ・アドミニストレーター(URA)、および総務課広報係の助言と支援を受けました。
<論文情報>
タイトル: Animal-sourced model of human norovirus infection predicted using environmental DNA metabarcoding analysis
(和訳)環境DNAメタバーコーディング解析に基づいたヒトノロウイルス感染症の動物由来モデルの提唱
雑誌名: Journal of Freshwater Ecology
著 者: Yukuto Sato, Jun Yasuda, Masahiro Sakurai
佐藤行人(琉球大学 医学部附属実験実習機器センター 准教授)、安田純(宮城県立がんセンター がん制御研究部 部長)、櫻井雅浩(仙台大学 体育学部 教授)
DOI番号: 10.1080/02705060.2023.2293171
URL: https://www.tandfonline.com/doi/10.1080/02705060.2023.2293171
