琉球大学・戦略的研究プロジェクトセンターの和智仲是特命助教、神戸大学・大学院農学研究科の前藤 薫教授、同大学・大学院生のJin-Je Gau氏(当時)と藤江隼平氏(当時)・深野堅哉氏らの研究グループによる成果が、生態学・進化生物学・生化学および分子生物学の3分野でのトップジャーナルである「Molecular Ecology」の電子版に掲載されました。
<発表のポイント>
|
琉球大学・戦略的研究プロジェクトセンターの和智仲是特命助教、神戸大学・大学院農学研究科の前藤 薫教授、同大学院生のJin-Je Gau氏(当時)と藤江隼平氏(当時)、深野堅哉氏らの研究グループは、西日本に生息する寄生蜂の一種であるギンケハラボソコマユバチ(Meteorus pulchricornis)(図1)について、次世代シーケンサー(注1)を用いたゲノム(注2)規模のDNA塩基配列解析を行い、メスだけで単為繁殖をする無性生殖がこの種でどのように進化し、遺伝的多様性が維持されているのかという点の解明に挑戦しました。

図1. ハスモンヨトウ幼虫に産卵するギンケハラボソコマユバチのメス成虫(右上, 写真提供:杉浦真治准教授・神戸大学大学院農学研究科)と調査地の様子(ギンケハラボソコマユバチの有性生殖集団と無性生殖集団が共存する大豆畑。香川県高松市)
その結果、1) 無性生殖集団はひとつの集団ではなく、多くの遺伝的集団に分かれていて、そのいくつかは同所的に生息している有性生殖集団から明確に分化している一方で、他のいくつかは有性集団から遺伝的に区別できないこと、2) 無性生殖集団は単一起源の可能性が高いこと、3) 一部の無性生殖集団はまれに有性生殖を再開することで有性生殖集団との遺伝的交流を行い、これによって遺伝的な多様性が維持されている可能性のあることが明らかになりました。
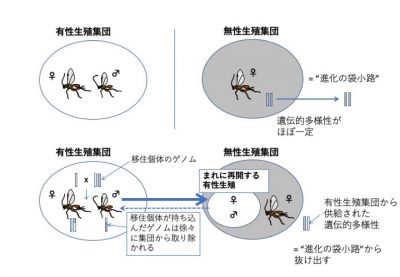
メスだけで単為繁殖する(クローンばかりになる)と遺伝的多様性が失われるため、無性生殖は一般的に“進化の袋小路”と考えられています。しかし、この寄生蜂はまれに有性生殖を再開して有性生殖集団との間で遺伝的交流を行い、この機構によって無性生殖集団を存続させている可能性が示唆されました。
<研究の背景>
「有利なはずの無性生殖がまれ」という矛盾
有性生殖にはオスを生むという大きなコストが掛かるので、メスだけで繁殖をする無性生殖はきわめて効率的な生殖方法と考えられます。しかし実際には、集団全体が無性生殖を行う生物種は多くありません。この理由についてまだ定説はありませんが、「赤の女王仮説」(注3)や「性機能による有害遺伝子の除去仮説」(注4)などいくつかのアイデアがあります(West et al. 1999)。いずれも、メスだけで繁殖する無性生殖では遺伝的多様性が失われるため、無性生殖系統は進化的に短命であると予測しています。もしも本当に性 (すなわちゲノムの組換え) による遺伝的多様性の維持に有益な機能があるのであれば、現存する無性生殖集団も何らかの方法で、その機能を補っているはずです。
そこで研究グループは、同一種内の無性生殖集団と有性生殖集団との遺伝的多様性を比較することで、無性生殖集団の起源と維持について理解を深められると考えました。無性生殖集団が長期にわたって遺伝的多様性を維持する機構として、1) 遺伝的な多様性を失わない細胞学的機構、2) 何度も繰り返される有性生殖集団から無性生殖集団への進化、3) 有性生殖集団から無性生殖集団への遺伝子流動などの仮説が考えられます(Simon et al. 2003)。しかし、この3つの遺伝的多様性の源の相対的な重要性は、現在のところよく分かっていません。
ギンケハラボソコマユバチという小さな寄生蜂
鱗翅 [チョウ] 目の幼虫に寄生するギンケハラボソコマユバチ Meteorus pulchricornis (膜翅 [ハチ] 目, コマユバチ科) という寄生蜂は、この3つの遺伝的多様性の源の相対的な重要性を調べるのに非常に適した種です。このハチはヨーロッパから中国・韓国・日本までの旧北区(注5)地域に自然分布しています(Maeto 2018)。他のハチと同様に、有性生殖では未受精卵は一倍体のオスに発達し、受精卵は二倍体のメスに発達します(図2)。ところが東アジアでは、オスと交尾せずに二倍体のメスのみを産む無性生殖集団も知られています。とくに西日本には有性生殖集団と無性生殖集団が同所的に分布する生息地が存在し、本研究の絶好の対象となりました。今回、上述した3つの仮説を基にして検討しました。
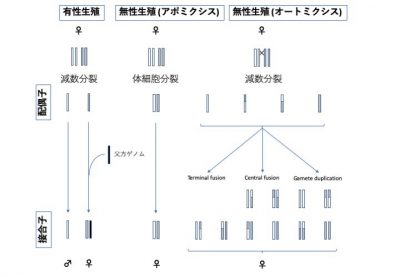
図2. ハチ目昆虫の生殖様式(Rabeling & Kronauer, 2014を元に作図)。オートミクシスでの組換えを "X"で示す。オートミクシスはさらに細かく分類することができるが、いずれの場合も世代ごとにホモ接合(注6)が増えると予想される。
仮説1:特異な生殖様式が遺伝的多様性に貢献?→「メセルソンの効果」仮説
このハチの無性生殖系統の生殖細胞では減数分裂過程が観察されないことから、母と娘が遺伝的に等しいクローンであると考えられています(Tsutsui et al. 2014)。このような生殖様式の細胞学的メカニズムは、アポミクシスと呼ばれています(図2中)。他のハチ目昆虫でよく見られるオートミクシス(図2右)では減数分裂によって生じた染色体が融合してホモ接合(注6)に移行するために遺伝的な多様性がしだいに失われてしまうのですが、母と娘が遺伝的に等しいアポミクシスなら祖先の遺伝的多様性を維持することができます。さらに、それだけでなく長期的なアポミクシスは、メセルソンの効果(注7)により遺伝的多様性を高める可能性があります。これを明らかにするために、ゲノム規模の遺伝的多様性を無性生殖集団と有性生殖集団を比較しました。
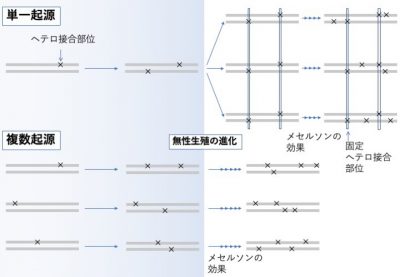
図3. 単一起源の場合・複数起源の場合で予想される遺伝的多様性のパターン。アポミクシスが進化した後、任意の遺伝子座の2つの対立遺伝子に独立した突然変異が蓄積する(メセルソンの効果)。集団中に固定したヘテロ接合部位は、それらが同じ起源であることを示唆する。そのような部位が存在しなければ、複数起源が示唆される。
仮説2:有性生殖集団から繰り返し進化して遺伝的多様性を維持?→「繰り返し進化」仮説
複数の無性生殖集団の遺伝的多様性のパターンを比較することで、その進化的起源を探ることができます。具体的には、複数の無性生殖集団に特定のヘテロ接合部位(注8)が固定されていれば、それらが共通の起源を持つことが示唆されます(図3)。一方で、そのような部位が存在しない場合は、無性生殖の複数起源が示唆されます(図3)。このように、ゲノム規模の遺伝的多様性を調べる手法を応用し、無性生殖集団の起源について検討しました。
仮説3:有性生殖集団からの遺伝子流動が遺伝的多様性の源?→「遺伝子流動」仮説
ギンケハラボソコマユバチの無性生殖集団のメスの中には、交尾をせずに娘と息子の両方を産む個体がまれに観察されることから、無性生殖系統のメスは低い頻度であれ一時的に減数分裂を再開している可能性があります(Fujie et al. 2019)。まれに生まれるオスが生殖能力を持つかどうか、また一時的に減数分裂を再開したメスが有性オスと交尾してその精子を利用する能力を維持しているかどうかは不明ですが、無性生殖集団の遺伝的多様性の維持には、このような個体を介した有性生殖集団からの遺伝子流動が重要な役割を果たしている可能性があると考えました。まれに生まれるオスが生殖能力を持ち、メスも精子を利用する能力を維持していると仮定すると、有性生殖集団から無性生殖集団へ、またはその逆の遺伝子流動(注9)が観察されるはずです。このような傾向がギンケハラボソコマユバチの野外集団に見られるかどうかを、ゲノム規模のDNA塩基配列情報を用いて調べました。
<研究の成果>
西日本各地から収集した、合計102個体の試料からDNAを抽出し、次世代シーケンシング技術を用いたゲノム解析手法であるMIG-seq法(ミグセック:注10)により、ゲノム規模のDNA遺伝子配列情報の取得を行いました(個体あたり約16万配列)。その結果、96個体から614箇所のSNP(スニップ、一塩基多型:注11)を含む遺伝子座が得られました。それぞれの遺伝子座が持つ情報を用いて、遺伝的多様性について解析しました。
仮説1「メセルソンの効果」は当てはまらない
得られたSNP情報を用いて集団クラスター解析(注12)を行ったところ、生殖型と遺伝的特徴の組み合わせによって5つの集団が見出されました(図4)。それらは、1 )沖縄・奄美の有性生殖集団、2)本州・四国の有性生殖集団、3)本州・四国の無性生殖集団A0、4)四国の無性生殖集団A1、5)四国の無性生殖集団A2、というものでした。当初の予想に反して、無性生殖集団がいくつもの集団に分かれることが明らかになりました。
有性生殖集団と無性生殖集団の遺伝的多様性の程度を比較したところ、明確な違いは見られませんでした。このことから、メセルソンの効果による遺伝的多様性の蓄積は見られないことが明らかになりました。遺伝的多様性の源としての「メセルソンの効果」仮説はギンケハラボソコマユバチには当てはまらないと考えています。
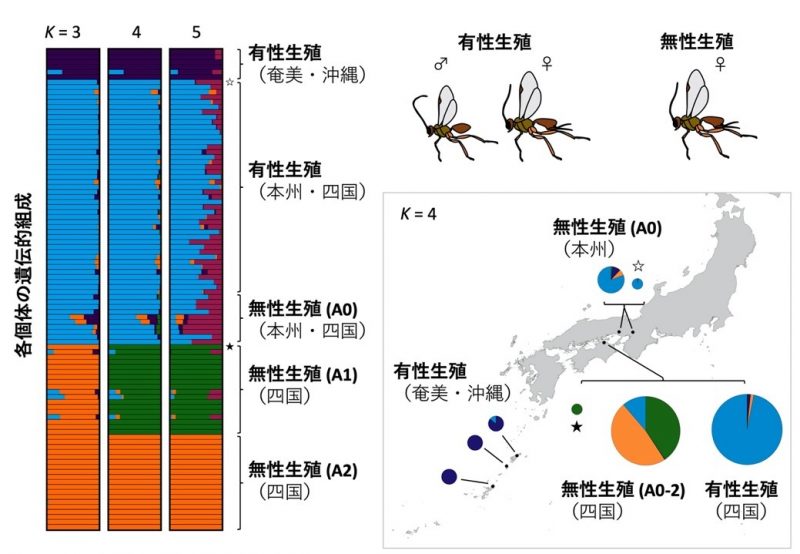
図4. ゲノム規模(614 SNPs)のDNA塩基配列情報に基づく高解像度な集団ゲノム解析の結果。集団クラスター解析(左の棒グラフ)の結果および地図上に結果を反映したもの(右図)を示している。それぞれのバーは個体を表し、それぞれの色が推定された祖先集団を表している。Kは祖先集団の数を示し、それぞれ祖先集団が3つのとき、4つのとき、5つのときを仮定した場合の集団構造を示している。☆は本州のオス個体、★は四国の無性で息子と娘を産んだメス個体を示す。
仮説2「繰り返し進化」の可能性も低い
見出された3つの無性生殖集団が共通の起源を持つのか、それとも独立の起源をもつのかを調べるために、固定ヘテロ接合部位の探索を行いました。その結果、3つの集団で完全に固定したヘテロ接合部位は見つかりませんでしたが、1箇所だけほぼ固定した部位が見出されました。また、四国の無性生殖集団A1とA2は4箇所の完全に固定したヘテロ接合部位を共有していました。これらのことから、少なくとも、3つのうちの2集団は独立に無性生殖能を獲得したわけではなく、無性生殖が進化した後に分集団化したのだろうと推測されました。このことから、ギンケハラボソコマユバチでは無性化は起こりにくく、遺伝的多様性の源として「繰り返し進化」仮説の可能性も低そうです。
仮説3「遺伝子流動」を支持
SNP情報を用いることで集団間の遺伝子流動の程度を推定することができます。その結果、興味深いことに、固定したヘテロ接合部位を他の無性生殖集団とわずかしか共有しない集団A0と有性生殖集団でのみ遺伝子流動が検出されました(図5)。さらに興味深いことに、その方向は、有性生殖集団から無性生殖集団への方向でした。このことは、ごくまれに生まれるオスや一時的に有性生殖を再開するメスが、有性生殖集団の個体と交配していることを強く示唆しており、「遺伝子流動」仮説を支持しています。この有性生殖集団からの無性生殖集団への遺伝子流動はこれまであまり注目されてきませんでした。しかし、近年、他の生物種(ハチやアザミウマ・アブラムシ・ミジンコ)でもそうした現象が報告されており、無性生殖集団の遺伝的多様性を維持するうえで重要な役割を果たしている可能性があります(Schneider et al. 2003; Sandrock et al., 2011; Galimov et al. 2011; Halkett et al. 2008; Li et al. 2015)。
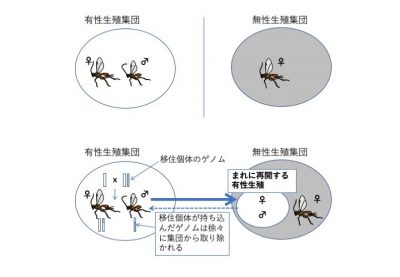
図5. 有性生殖集団と無性生殖集団間で推定された遺伝子流動の模式図。推定された遺伝子流動の方向性は「まれに再開する有性生殖」を仮定するとよく説明できる。
<社会的意義・今後の展開>
本研究によって、ある種の寄生蜂の無性生殖集団に明確な遺伝的集団構造が見られること、さらに一時的に有性生殖を再開することで有性生殖集団からの遺伝子流動を受け入れていることが示唆されました。無性生殖集団における遺伝的多様性の源として、有性生殖集団からの遺伝子流動の重要性を示唆する、まだ数少ない事例といえます。このハチはこうした遺伝子流動により“進化の袋小路”から抜け出している可能性があります。今後、こうした現象が、他の昆虫や生物にも言えることなのかどうか、その普遍性について検証する必要があります。また、本研究ではどのようなメカニズムで無性生殖が行われているのか、その至近要因(注13)については明らかにできていません。その点が明らかになれば、より具体的に無性生殖の進化について議論することができるようになるでしょう。
今回の論文では議論することができませんでしたが、本研究の成果は昆虫の農業利用にも新たな視点を与えるものです。農業害虫に寄生する寄生蜂は、天敵農薬(注14)として活用が注目されています。メスだけで増殖することができる無性生殖系統の寄生蜂は、高い増殖率を持つために天敵農薬として優れています。その一方で、無性生殖系統は遺伝的多様性に乏しいという欠点も指摘されています。そこで、無性系統が部分的に有性生殖を行う性質を上手く利用すれば、天敵として有用な性質を有性生殖集団から無性生殖系統に導入することができます。このように天敵農薬の新しい育種方法に現実味を与えるという意味でも、本研究結果には大きな意義があると考えています。
<用語解説>
※共通する用語が多いため、下記のプレスリリースも合わせてご確認ください。
1. 琉球大学プレスリリース・2020年12月25日・「高解像度な集団遺伝解析で迫る、琉球列島のシロオビアゲハの進化~擬態する個体が混在する、ダーウィン時代以来の蝶の不思議~」
2. 琉球大学プレスリリース・2021年1月25日・「ゲノム解析によって明らかになった宮古諸島の人々の由来」
注1 次世代シーケンサー:数千から数百万のDNA塩基配列を並列に解析することにより、短時間で大規模のDNA塩基配列の解読を行うことができる装置
注2 ゲノム:染色体のDNAに含まれるすべての遺伝情報
注3 赤の女王仮説:病原体の病原性と宿主の抵抗性のように互いに変化し続ける現象を、ルイス・キャロルの小説「鏡の国のアリス」の赤の女王という登場人物の台詞「その場にとどまるためには、全力で走り続けなければならない」に例えたもの。有性生殖の場合は組換えにより、より多くの組み合わせの抵抗性遺伝子のタイプを持つことができ、病原体により対抗できる。
注4 性機能による有害遺伝子の除去仮説:組換えのない無性生殖個体のゲノムでは有害な突然変異が生じた場合に染色体から取り除くことができない。一方で有性生殖の場合は組換えにより有害な突然変異を持たない染色体を生み出すことができる。
注5 旧北区:生物地理区の一つで、アフリカの北部からヨーロッパ、アジアを広く含むユーラシア大陸の一帯。
注6 ホモ接合: homozygous、Aとaという対立遺伝子をもつ二倍体生物の遺伝子座(注6-1)においてAAやaa のように同じ対立遺伝子をもつ状態。
注6-1 遺伝子座:生物のゲノムや染色体上での遺伝子の位置する場所。
注7 メセルソンの効果:無性生殖を行う二倍体の個体内の2つの対立遺伝子もしくは遺伝子のコピーは組換えが起きないため互いに独立して進化する。そのため、時間の経過とともに突然変異を蓄積し、同じ遺伝子座であるにもかかわらず遺伝的に遠く離れたものになる現象のこと。
注8 固定ヘテロ接合部位:DNA塩基配列のうち、集団中の全ての個体でヘテロ接合(注8-1)である塩基の位置。
注8-1 ヘテロ接合:heterozygous、Aとaという対立遺伝子をもつ二倍体生物の遺伝子座(注6-1)においてAaのように異なる対立遺伝子をもつ状態。
注9 遺伝子流動:ある集団から他の集団への遺伝子やゲノムの移動のこと。集団間で交配が起きることで起こる。
注10 MIG-seq法:multiplexed inter-simple sequence repeat (ISSR) genotyping via sequencingの略(ミグセック)。全ゲノム解析を行うわけではなくゲノムの概要の解析を行う縮約ゲノム解析の一つ(Suyama & Matsuki 2015)。主にゲノム全体に存在するISSR(ATAT ATなどの繰り返し配列に挟まれた領域)を対象としており、複数のPCRプライマーセットを用いて数千から数万個のDNA断片を同時に増幅し、次世代シーケンス解析に用いるライブラリを構築する。
注11 SNP:Single nucleotide polymorphism(一塩基多型)の略(スニップ)。ゲノムのDNA塩基配列中で一塩基が変異した遺伝的多様性のこと。
注12 集団クラスター解析:集団遺伝学的解析の一つ。SNP情報に基づいて、その個体が属している遺伝的集団を推定する方法。今回は ADMIXTURE というツールを用いた。
注13 至近要因:生理機構や遺伝子発現など、進化形質を制御する直接的な因子のこと。ここでは、どのような遺伝子が進化することで無性生殖が進化するのかということ。
注14 天敵農薬:アブラムシを食べるテントウムシやイモムシに寄生する寄生蜂のような天敵を害虫の防除目的で利用すること。
<引用文献>
Fujie, S., Wachi, N., Umemoto, H., & Maeto, K. (2019). Mitochondrial DNA diversity and geographical distribution of sexual and asexual strains of the braconid parasitoid Meteorus pulchricornis. Entomologia Experimentalis et Applicata, 167(12), 977–985.
Galimov, Y., Walser, B., & Haag, C. R. (2011). Frequency and inheritance of non-male producing clones in Daphnia magna: Evolution towards sex specialization in a cyclical parthenogen? Journal of Evolutionary Biology, 24(7), 1572–1583.
Halkett, F., Plantegenest, M., Bonhomme, J., & Simon, J.-C. (2008). Gene flow between sexual and facultatively asexual lineages of an aphid species and the maintenance of reproductive mode variation. Molecular Ecology, 17(12), 2998–3007.
Li, X.-W., Wang, P., Fail, J., & Shelton, A. M. (2015). Detection of gene flow from sexual to asexual lineages in Thrips tabaci (Thysanoptera: Thripidae). PloS One, 10(9), e0138353.
Maeto, K. (2018). Polyphagous koinobiosis: the biology and biocontrol potential of a braconid endoparasitoid of exophytic caterpillars. Applied Entomology and Zoology, 53(4), 433–446.
Rabeling, C., & Kronauer, D. J. (2013). Thelytokous parthenogenesis in eusocial Hymenoptera. Annual Review of Entomology, 58, 273–292.
Sandrock, C., Schirrmeister, B. E., & Vorburger, C. (2011). Evolution of reproductive mode variation and host associations in a sexual-asexual complex of aphid parasitoids. BMC Evolutionary Biology, 11(1), 348.
Schneider, M. V., Driessen, G., Beukeboom, L. W., Boll, R., Van Eunen, K., Selzner, A., … Lapchin, L. (2003). Gene flow between arrhenotokous and thelytokous populations of Venturia canescens (Hymenoptera). Heredity, 90(3), 260–267.
Simon, J.-C., Delmotte, F., Rispe, C., & Crease, T. (2003). Phylogenetic relationships between parthenogens and their sexual relatives: the possible routes to parthenogenesis in animals. Biological Journal of the Linnean Society, 79(1), 151–163.
Suyama, Y., & Matsuki, Y. (2015). MIG-seq: an effective PCR-based method for genome-wide single-nucleotide polymorphism genotyping using the next-generation sequencing platform. Scientific Reports, 5(1), 16963.
Tsutsui, Y., Maeto, K., Hamaguchi, K., Isaki, Y., Takami, Y., Naito, T., & Miura, K. (2014). Apomictic parthenogenesis in a parasitoid wasp Meteorus pulchricornis, uncommon in the haplodiploid order Hymenoptera. Bulletin of Entomological Research, 104(3), 307–313.
West, S. A., Lively, C. M., & Read, A. F. (1999). A pluralist approach to sex and recombination. Journal of Evolutionary Biology, 12(6), 1003–1012.
<謝辞>
本研究の一部は、文部科学省・科学研究費補助金(17K19268, 19H00942)および琉球大学において推進されている「時空間ゲノミクス」プロジェクトの支援を受けました。また、本研究の解析の一部では、情報・システム研究機構・国立遺伝学研究所が有する遺伝研スーパーコンピュータシステムを利用しました。
<論文情報>
掲載誌: Molecular Ecology
論文タイトル:Genomic population structure of sympatric sexual and asexual populations in a parasitic wasp, Meteorus pulchricornis (Hymenoptera: Braconidae), inferred from six hundred single-nucleotide polymorphism loci
(日本語訳:ギンケハラボソコマユバチ (膜翅 [ハチ] 目: コマユバチ科)の約600の一塩基多型遺伝子座から推定した同所的に分布する有性集団と無性集団の遺伝的集団構造)
著者:Nakatada Wachi*, Jin-Je Gau, Shunpei Fujie, Kenya Fukano, & Kaoru Maeto*(下線:同等の貢献による共同筆頭著者, *:責任著者)
URL/DOI番号:https://doi.org/10.1111/mec.15834
アブストラクトURL:https://onlinelibrary.wiley.com/doi/abs/10.1111/mec.15834