|
琉球大学熱帯生物圏研究センターの高江洲准教授、松﨑教授らの研究チームによる研究成果が、米国連邦実験生物学会の学術誌「The FASEB Journal」に掲載されました。 <発表のポイント(図1参照)>
|
<発表概要>
1. 研究の背景
結核は結核菌という細菌の感染によって引き起こされ、今なお世界で毎年100万人以上の命を奪う重大な感染症であり、世界保健機関(WHO)が世界三大感染症の一つとして重点的な対策を求めている疾患です。結核の治療には結核菌に対する複数の抗生物質を一定期間投与する多剤併用療法が適用されますが、投与の条件が厳格に守られない状況下などで抗生物質に耐性を持つ多剤耐性菌の出現が大きな脅威となっています。このような多剤耐性結核菌にも対処可能な新たな結核治療薬の開発が世界的な課題となっています。
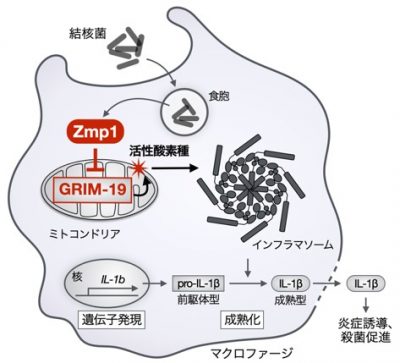
結核菌は、免疫細胞の一つであるマクロファージ(※1)の細胞内に寄生して増殖する特徴を持っています。通常の細菌はマクロファージに取り込まれると殺菌されますが、結核菌はマクロファージが殺菌作用を発揮するのに必要な分子の機能を抑える様々な病原因子を持っているため、マクロファージ内で殺菌されず、結核菌の細胞内への寄生が成立します(以降、寄生された細胞を宿主と呼びます)。結核菌が細胞内に寄生すると、体液中の抗菌分子(抗体など)による攻撃も受けることがなくなり、その結果、マクロファージが結核菌を守り増殖する場を提供することになってしまいます。これが、免疫系がなかなか結核菌を排除できない理由の一つです。したがって、結核菌の細胞内寄生に必要な病原因子の働きを阻害する方法を開発すれば、マクロファージの殺菌作用を強化でき、宿主の免疫応答を増強することで結核菌を排除できる可能性が考えられます。
これまでに、結核菌の持つタンパク質分解酵素の一種である亜鉛メタロプロテアーゼ1(Zmp1)が、細胞内寄生に必須であることが知られていました。Zmp1はマクロファージから産生され宿主の殺菌活性を増強する炎症性サイトカイン、インターロイキン-1β (IL-1β)(※2)の生成を抑制することが知られていましたが、宿主の何に働きかけ、どの様な過程で細胞内寄生を成立させているかは不明でした。そこで、本研究では宿主側でZmp1の標的となっている分子の同定とその分子の機能解析を通じて、Zmp1によるIL-1βの産生阻害の分子機序の解明に取り組みました。
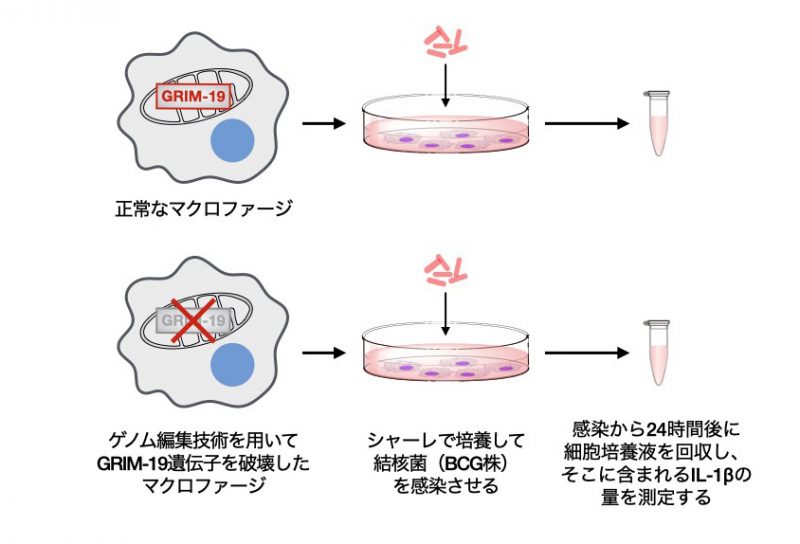
図2:本研究で行った実験の模式図。正常なマクロファージ(上段)、GRIM-19遺伝子を
破壊したマクロファージ(下段)に結核菌を感染させ、IL-1βの産生を確認した。
2. 研究内容
まず、酵母ツーハイブリッドスクリーニングという方法を用いて、Zmp1と会合する宿主タンパク質を探索し、その候補の一つとしてミトコンドリア呼吸鎖(※3)複合体Iを構成するサブユニットの一つであるGRIM-19というタンパク質を特定しました。これまでに、GRIM-19がIL-1βの産生制御に関わるという報告はありません。そこで、マクロファージにおけるGRIM-19の役割を明らかにするために、ゲノム編集技術を用いてGrim-19遺伝子を破壊(ノックアウト)したマウスマクロファージ細胞株を樹立し、その細胞の応答を調べました(図2参照)。結核菌の弱毒ワクチン株であるBCGを正常なマクロファージに感染させる実験を行ったところ、野生型BCGを感染させた正常マクロファージからはIL-1βの産生がほとんど見られないのに対して、Zmp1欠損BCG (∆zmp1-BCG)を感染させたマクロファージからはIL-1βの産生が認められました。つまり、Zmp1は確かにIL-1βの産生を阻害することが確認できました。一方、Grim-19欠損マクロファージに∆zmp1-BCGを感染させた場合は、IL-1βの産生が完全に抑制されました。このことから、GRIM-19がBCG感染によって誘導されるIL-1βの産生に必須であることが明らかとなりました(図3参照)。
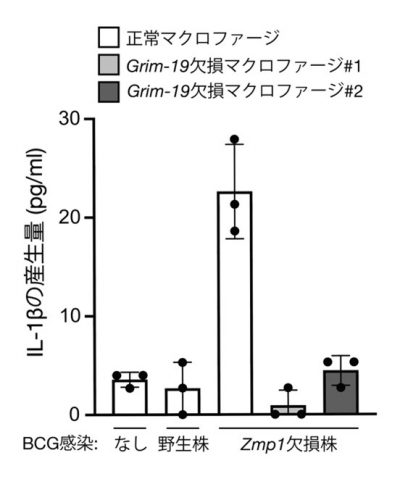
図3:正常マクロファージ、Grim-19欠損マクロファージに結核菌の野生株、
Zmp1欠損株を感染させた実験の結果
次に、GRIM-19がどのようにIL-1βの産生を制御するのか、その分子メカニズムの解明に取り組みました。IL-1βの産生にはインフラマソーム(※4)と呼ばれるタンパク質複合体が重要な役割を果たします。インフラマソームはセンサータンパク質・アダプタータンパク質・タンパク質分解酵素(カスパーゼ1)から構成されます。インフラマソームはセンサータンパク質の違いによっていくつかの種類に分けられますが、中でもNLRP3というタンパク質をセンサーとするインフラマソームは結核菌に感染したマクロファージからのIL-1βの産生に重要な役割を果たすことが知られています。そこで、GRIM-19がNLRP3インフラマソームの活性化を制御するとの仮説を立て、Grim-19欠損マクロファージを用いてそれを検証しました。その結果、Grim-19欠損マクロファージではNLRP3インフラマソーム活性化刺激に応答したIL-1βの産生もカスパーゼ1の活性化も起こらないことがわかりました。すなわち、GRIM-19はNLRP3インフラマソーム活性化に必須であることが明らかとなりました(図4参照)。
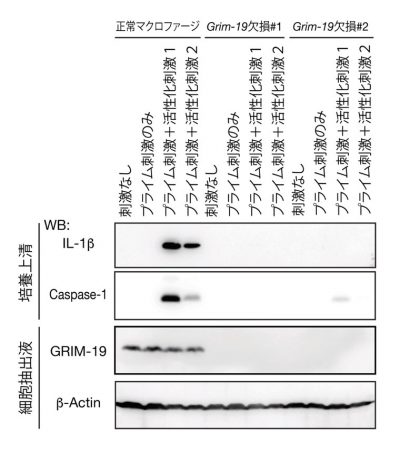
図4:正常なマクロファージ、Grim-19欠損マクロファージにおける
NLRP3インフラマソーム活性化刺激への応答
NLRP3インフラマソームの活性化にはミトコンドリアに由来する活性酸素種(mtROS)が重要な役割を果たすことが知られています。また、mtROSの産生にはミトコンドリア呼吸鎖複合体Iが大きく寄与することも知られています。そこで、GRIM-19がmtROSの産生を介してNLRP3インフラマソームの活性化を制御する可能性を検証しました。正常マクロファージとGrim-19欠損マクロファージで、NLRP3活性化刺激で誘導されるmtROSの量を測定したところ、Grim-19欠損マクロファージではmtROSの産生が誘導されないことがわかりました。さらに、呼吸鎖複合体Iの活性化の一つの指標として、ミトコンドリア内膜の膜電位を解析したところ、Grim-19欠損マクロファージでは正常マクロファージと比べて、膜電位が有意に低下することも分かりました。また、一過的な遺伝子導入によりZmp1を強制的に発現させた細胞(結核菌感染によって細胞内にZmp1タンパク質が発現する状況を擬似的に再現)でも膜電位が有意に低下すること、その低下の度合いは呼吸鎖複合体Iの阻害剤を添加した場合と同程度であることが分かりました(図5参照)。これらの結果から、GRIM-19は呼吸鎖複合体IからのmtROSの産生に必須の役割を果たしており、mtROSを介してNLRP3の活性化を制御することが示唆されました。
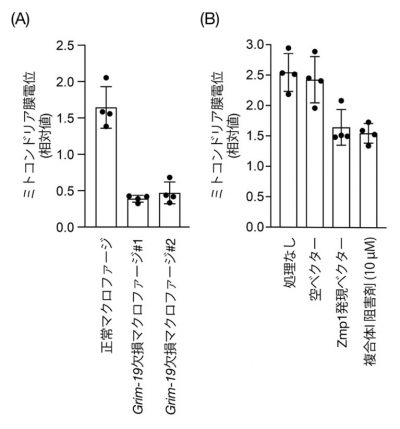
図5: (A) 正常マクロファージ、Grim-19欠損マクロファージにおけるミトコンドリア膜電位の比較。
(B)Zmp1を発現させた培養細胞におけるミトコンドリア膜電位の変化。
3. 今後の展開
本研究では、結核菌がマクロファージ内に寄生するために重要な役割を果たす病原因子の一つZmp1が宿主のGRIM-19と会合すること、および、GRIM-19がNLRP3インフラマソームの活性化に必須の役割を果たすことを見出しました。Zmp1の標的が具体的に明らかになったことにより、今後はZmp1とGRIM-19の相互作用を阻害する薬剤を探索・開発することで、Zmp1によるIL-1βの産生阻害を解除し、マクロファージの正常な免疫応答を引き出せるようになる可能性があります。そのような薬剤は結核菌に直接作用する従来の抗菌薬とは異なり、宿主免疫の増強によって菌の排除を促進することから、多剤耐性結核菌に対しても有効な治療薬となるものと期待されます。今後は、Zmp1によるGRIM-19の機能阻害の詳細なメカニズムを解明し、Zmp1の作用を阻害する方法の開発を進めていきます。
4. 研究体制、および本研究への支援について
本研究は、琉球大学熱帯生物圏研究センター(分子感染防御学分野)および大学院医学研究科(生体防御学講座)藏根友美(大学院博士課程)・澤田和子研究員・福井雅之研究員・梅村正幸准教授・松﨑吾朗教授・高江洲義一准教授、東北大学大学院医学系研究科(環境医学分野)松永哲郎助教・井田智章助教・西村明助教・赤池孝章教授、岡山大学学術研究院医歯薬学域(口腔微生物学分野)中山真彰助教・大原直也教授、新潟大学大学院医歯学総合研究科(細菌学分野)松本壮吉教授の共同研究として行われました(所属・役職名は研究実施当時のもの)。また、本研究は、科研費(18K07179、20H03487)、公益財団法人武田科学振興財団、公益財団法人ノバルティス科学振興財団、琉球大学熱帯生物圏研究センター共同利用・共同研究による支援を受けて実施されました。
5. クラウドファンディングについて
従来の研究助成に加えて、本研究では学術系クラウドファンディングサイト「academist(アカデミスト)」を通じたプロジェクト「結核の新たな治療法として『免疫療法』を確立したい!」(松﨑・高江洲)(https://academist-cf.com/projects/144?lang=ja)の支援も受けて実施しました。このプロジェクトは琉大公認の研究クラウドファンディング第1号で、合計91名のサポーターの方々から支援を頂いております。
6. 論文情報
【掲載誌】The FASEB Journal
【巻・号・ページ・年】Volume 36, Issue 1, e22096, 2022
【オンライン掲載日】2021年12月14日(日本時間15日)
【論文タイトル】GRIM-19 is a target of mycobacterial Zn2+ metalloprotease 1 and indispensable for NLRP3 inflammasome activation
(タイトル和訳) GRIM-19はマイコバクテリアのZn2+ metalloprotease 1の標的であり、NLRP3インフラマソームの活性化に必要不可欠である
【著者】Kurane T, Matsunaga T, Ida T, Sawada K, Nishimura A, Fukui M, Umemura M, Nakayama M, Ohara N, Matsumoto S, Akaike T, Matsuzaki G*, Takaesu G*.
【doi】10.1096/fj.202101074RR
【URL】https://faseb.onlinelibrary.wiley.com/doi/10.1096/fj.202101074RR
7. 用語解説
(※1) マクロファージ:白血球の一種。感染防御の最前線で働き、病原体を取り込んで殺菌する能力を持つ。その一方で、結核菌に対しては菌の増殖の場となることがある。
(※2) インターロイキン-1β(IL-1β):免疫系における細胞間コミュニケーションを司るサイトカインの一種。主に炎症を誘導する他、マクロファージの殺菌能力を高める働きもある。
(※3) ミトコンドリア呼吸鎖:生物のエネルギー源であるアデノシン三リン酸 (ATP)の合成に関わる、ミトコンドリア内の一連のタンパク質複合体群。IからIVの四つの複合体から構成され、ミトコンドリア内膜を介した膜電位を形成する。
(※4) インフラマソーム:活性のある成熟型IL-1βの産生を担うタンパク質複合体。感染防御のみならず、慢性炎症性疾患とも深く関わることが知られている。